АСД фракция 2 для похудения: как принимать, инструкция
Обновлено: 03.01.2023
Препарат АСД-2 был разработан кандидатом наук А.В. Дороговым по заказу правительства СССР в 1947 году. Согласно предъявленным требованиям, необходимо было разработать препарат-иммуностимулятор, способный противостоять радиационному воздействию и серьезным инфекциям, будучи при этом недорогим и доступным для широкой аудитории.
Сегодня с помощью этого средства можно избавиться от широкого спектра недугов, в том числе и избыточного веса. Рассмотрим, как принимать АСД фракцию 2 для похудения.
Лекарственный препарат АСД фракция 2 – антисептик-стимулятор Дорогова – получил свое название в честь ученого А.В. Дорогова, создавшего препарат. Первоначально средство выпускалось как концентрат, приготовленный в специальном аппарате при очень высоких температурных значениях, в качестве сырья для него использовались ткани лягушек, нагретых на специальном аппарате. Позднее Дорогов заменил лягушек на мясокостную муку.
- Первая из фракций не обладала какими-либо лечебными свойствами.
- Вторая и третья попытки создания препарата увенчались успехом: фракция 2 и 3 способны оказывать оздоровительное воздействие на организм человека и животных. Так, например, АСД-2 эффективно показала себя при лечении бронхиальной астмы, которая до того времени не поддавалась лечению.
АСД-2 представляет собой водный раствор желтоватого цвета, в котором содержатся органические и неорганические соединения.
Рассмотрим состав лекарственного средства :
- Муравьиная, уксусная и пропионовая кислоты. Относятся к слабым кислотам, вместе со спиртами образуют сложные эфиры, содержащиеся в натуральных продуктах;
- Алициклические углеводороды – помогают бороться с микробами и вирусами;
- Амиды – производные корболовых и минеральных кислот. Они помогают проникать действующим веществам средства внутрь клеток организма.
 Именно амиды виноваты в резком неприятном запахе препарата;
Именно амиды виноваты в резком неприятном запахе препарата; - Атомы водорода и серы – стабилизируют белковую структуру, препятствуют образованию токсинов и выводят их из организма.
- Мясокостная мука – богата белком,позволяет сбалансировать рацион питания.
Среди полезных эффектов применения АСД-2 человеком можно отметить:
- Снижает чувство голода. Насыщение наступает быстрее, что препятствует перееданию;
- Нормализует пищеварение;
- Восстанавливает слизистую желудка, тормозит воспалительные процессы, препятствуя появлению изжоги и постоянной тяги к перекусам;
- Оказывает иммуностимулирующее действие, придает силы организму.
Лекарства для улучшения сна: виды, принцип действия и побочные эффекты
Таким образом, АСД фракция 2помогает и при избыточном весе. К нему приводит избыток жировой ткани, которая образуется из-за природной склонности к полноте, малоподвижного образа жизни и неправильного питания.
Вместе со средством идет инструкция по применению:
- Средство нельзя открывать. Отогните середину металлического колпачка, не снимая пробки;
- Введите в крышку иглу от шприца, вставьте шприц;
- Встряхните флакон несколько раз и переверните так, чтобы крышка оказалась внизу;
- Наберите в шприц жидкость;
- Достаньте шприц, оставив иглу внутри пробки, заклейте пластырем, чтобы препарат не выдыхался;
- Опустите шприц в заранее приготовленный чай или воду;
- Медленно введите лекарство в чай и перемешайте.
Пить АСД-2 нужно один раз в день натощак (за 40 минут до приема пищи), для этого необходимо растворить препарат в 100 г кипяченой воды (или чая) комнатной температуры.
- 1-5 день: минимальная доза 35 капель, максимальная – 40;
- 6-10 день: перерыв;
- 11-14 день: пить 10 капель за прием;
- 15-17 день: перерыв.

- 18-20 день: 25 капель, после чего цикл завершается.
Несколько советов, как побороть специфический запах препарата:
- Готовьте раствор в проветриваемой комнате или на балконе.
- Перед употреблением сделайте глубокий вдох, а затем – резкий выдох.
- Пейте раствор задерживая дыхание.
- После – глубоко дышите носом и резко выдыхайте ртом.
Согласно инструкции, препарат не дает осложнений или побочных эффектов. Исключение – индивидуальная непереносимость компонентов препарата.
АСД-2 помогает снижать вес, но для получения лучшего результата также необходимо пересмотреть рацион питания и добавить в свой режим дня физические нагрузки, пробежки, велопрогулки, плавание.
Пожалуйста, оставьте ваш отклик по текущей теме статьи. Мы будем очень рады вашим подпискам, лайкам, откликам, дизлайкам! На нашем ресурсе, вы сможете узнать много полезного и интересного для вас, а если нашли ошибку, сообщите нам! Благодарим, за проявленный интерес к нашему сайту и данной статье!
АСД фракция 3 (Антисептик Дорогова) от 107 р.

Описание товара
АСД фракция 3 (Антисептик Дорогова) 100 мл
1. Торговое наименование лекарственного препарата: АСД фракция 3 (ASD fraction 3).
Международное непатентованное наименование: отсутствует.
2. Лекарственная форма: раствор для наружного и внутриматочного применения.
АСД фракция 3 содержит в своем составе комплекс биологических веществ, в том числе карбоновые кислоты, алифатические и циклические углеводороды, алкилбензолы и замещенные фенолы, алифатические амины и амиды, а также соединения с активной сульфгидрильной группой и воду.
По внешнему виду препарат представляет собой густую жидкость от темно-коричневого до черного цвета со специфическим запахом.
3. Выпускают АСД фракция 3 расфасованным по 100, 200 мл во флаконы соответствующей вместимости, укупоренные резиновыми пробками, укрепленными алюминиевыми колпачками. В каждую коробку вложена инструкция по применению.
4. Хранят лекарственный препарат в закрытой упаковке производителя, отдельно от продуктов питания и кормов, в сухом, защищенном от прямых солнечных лучей месте, при температуре от +100С до +300С.
Срок годности лекарственного препарата при соблюдении условий хранения 4 года со дня производства. Срок годности после первого вскрытия флакона — не более 14 суток.
Запрещается применение препарата АСД фракция 3 по истечении срока годности.
5. Лекарственный препарат следует хранить в местах, недоступных для детей.
6. Неиспользованный лекарственный препарат утилизируют в соответствии с требованиями законодательства.
II. Фармакологические свойства
7. АСД фракция 3 относится к тканевым препаратам. Биологически активные вещества, входящие в состав препарата АСД фракция 3, оказывают антисептическое и противовоспалительное действие, стимулируют активность ретикулоэндотелиальной системы, нормализуют трофику и ускоряют регенерацию поврежденных тканей.
АСД фракция 3 по степени воздействия на организм относится к умеренно опасным веществам (3 класс опасности по ГОСТ 12.1.007-76).
III. Порядок применения
8. АСД фракция 3 назначают животным для лечения инфицированных вяло заживающих ран, дерматитов, хронических воспалительных поражений кожи и копыт, трофических язв, свищей, копытной гнили овец и некробактериоза животных, а также гинекологических заболеваний различной этиологии.
9. Противопоказанием к применению препарата является индивидуальная повышенная чувствительность животного к компонентам препарата (в том числе в анамнезе).
10. При гинекологических заболеваниях АСД фракцию 3 применяют при вагинитах интравагинально, а эндометритах — внутриматочно в виде 20-50% масляных растворов, при заболеваниях кожи и копыт — наружно в нативном виде или в форме масляных растворов и мазей. Масляные растворы препарата готовят в асептических условиях с использованием касторового, льняного, подсолнечного, минерального масел, в которые при тщательном перемешивании добавляют АСД фракцию 3 в соотношении 1:1при тяжелой степени заболевания или 1:5 при средней и легкой степени заболевания.
При лечении инфицированных вяло заживающих ран и свищей, проводят санитарную обработку пораженного участка до полного удаления гнойного экссудата, и после этого накладывают смоченную 20% масляным раствором АСД фракции 3 марлевую салфетку, которую фиксируют бинтом. Смену салфеток с лекарственным препаратом проводят ежедневно в течение 5-7 дней до выздоровления животного.
При экземах, пролежнях, дерматитах, хронических воспалительных поражениях кожи, пиодермии и трофических язвах на пораженные участки кожи наносят стерильные масляные растворы препарата 20% при легкой и средней степени заболевания, а 50% при тяжелой степени заболевания один раз в сутки, с захватом 2-3 см здоровой кожи (с целью предупреждения распространения очага воспаления). Лечение проводят в течение 6-10 дней до выздоровления животного.
При обширных поражениях препарат наносят попеременно на разные участки, покрывая за одну обработку не более 1/10 поверхности тела животного.
При некробактериозе животных и копытной гнили овец после санитарной обработки пораженных участков конечностей их смазывают препаратом в нативном виде один раз в день курсами 10 дней, 2 дня перерыв до выздоровления животного. Лечение проводят в комплексе с местными хирургическими обработками и лекарственными средствами специфической и симптоматической терапии.
При вагинитах, эндометритах, пиометре, вызванных трихомонозом или патогенной микрофлорой коровам вводят во влагалище 20% масляный раствор препарата при помощи шприца Жане с катетером. На одну процедуру расходуют до 300 мл раствора. Рекомендуется также во влагалище вводить марлевые тампоны, пропитанные раствором. Лечение проводят 1 раз в день в течение 6-10 дней до выздоровления.
На одну процедуру расходуют до 300 мл раствора. Рекомендуется также во влагалище вводить марлевые тампоны, пропитанные раствором. Лечение проводят 1 раз в день в течение 6-10 дней до выздоровления.
11. При попадании на участки здоровых тканей большого количества нативного препарата возможно выраженное раздражение тканей вплоть до ожога. В этом случае необходимо удалить с поверхности ватно-марлевым тампоном остатки препарата и обильно промыть не менее 3-х раз водой.
12. Особенностей действия лекарственного препарата при его первом применении и отмене не выявлено.
13. Следует избегать пропусков при применении очередной дозы препарата, так как это может привести к снижению эффективности. В случае пропуска очередной обработки ее проводят в тех же дозировках по той же схеме.
14. Побочных явлений и осложнений при применении лекарственного препарата в соответствии с настоящей инструкцией, как правило, не наблюдается.
15. Сведения о несовместимости лекарственного препарата с другими лекарственными средствами отсутствуют.
16. Мясо продуктивных животных, а также молоко дойных животных во время и после применения препарата АСД фракция 3, используются в пищевых целях без ограничений. В случае вынужденного убоя животного, обработанные АСД фракцией 3 участки туши зачищают и утилизируют.
IV. Меры личной профилактики
17. При работе с АСД фракция 3 следует соблюдать общие правила личной гигиены и техники безопасности, предусмотренные при работе с лекарственными средствами. Во время работы запрещается курить, пить и принимать пищу. По окончании работы руки следует вымыть теплой водой с мылом.
18. При случайном контакте лекарственного препарата с кожей или слизистыми оболочками глаз, их необходимо промыть большим количеством воды. Людям с гиперчувствительностью к компонентам препарата следует избегать прямого контакта с АСД фракцией 3. В случае появления аллергических реакций или при случайном попадании препарата в организм человека следует немедленно обратиться в медицинское учреждение (при себе иметь инструкцию по применению препарата или этикетку).
19. Пустые флаконы из-под лекарственного препарата запрещается использовать для бытовых целей, они подлежат утилизации с бытовыми отходами.
20. Организация-производитель: ФКП «Армавирская биологическая фабрика»; 352212, Краснодарский край, Новокубанский р-н, п. Прогресс, ул. Мечникова, 11.
С утверждением настоящей инструкции утрачивает силу инструкция по применению АСД фракция 3, утвержденная Россельхознадзором 11 июля 2011 года.
Инструкция разработана ФКП «Армавирская биологическая фабрика»; 352212, Краснодарский край, Новокубанский р-н, п. Прогресс, ул. Мечникова, 11.
Рекомендовано к регистрации в Российской Федерации ФГБУ «ВГНКИ».
Номер регистрационного удостоверения 02-3-31.12-2353№ПВР-3-1.2/00911
Характеристика состава и фармакокинетическая оценка аморфных твердых дисперсий дазатиниба
1. Ломбардо Л.Дж., Ли Ф.Ю., Чен П., Норрис Д., Барриш Дж.К., Бениа К., Кастанеда С., Корнелиус Л.А.М., Дас Дж., Довейко А.М. , и другие. Открытие N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-пиперазин-1-ил]-2-метилпиримидин-4-иламино]тиазол-5-карбоксамида (BMS -354825), двойной ингибитор киназы Src/Abl с мощной противоопухолевой активностью в доклинических исследованиях. Дж. Мед. хим. 2004; 47: 6658–6661. дои: 10.1021/jm049486а. [PubMed] [CrossRef] [Google Scholar]
Дж. Мед. хим. 2004; 47: 6658–6661. дои: 10.1021/jm049486а. [PubMed] [CrossRef] [Google Scholar]
2. Drugs@FDA. Препараты, одобренные FDA. [(по состоянию на 5 июля 2022 г.)]; Доступно в Интернете: https://www.accessdata.fda.gov/scripts/cder/daf/
3. Токарски Дж.С., Ньюитт Дж.А., Чанг С.Ю.Дж., Ченг Дж.Д., Виттекинд М., Кифер С.Е., Киш К., Ли Ф.Ю. , Borzillerri R., Lombardo L.J., et al. Структура дазатиниба (BMS-354825), связанного с активированным киназным доменом ABL, объясняет его ингибирующую активность в отношении резистентных к иматинибу мутантов ABL. Рак Рез. 2006;66:5790–5797. doi: 10.1158/0008-5472.CAN-05-4187. [PubMed] [CrossRef] [Google Scholar]
4. Talpaz M., Shah N.P., Kantarjian H., Donato N., Nicoll J., Paquette R., Cortes J., O’Brien S., Nicaise C. , Блейкардт Э. и др. Дазатиниб при устойчивых к иматинибу филадельфийских хромосомных лейкозах. Н. англ. Дж. Мед. 2006; 354: 2531–2541. doi: 10.1056/NEJMoa055229. [PubMed] [CrossRef] [Google Scholar]
5. EMA Sprycel — дазатиниб — научное обсуждение. 2006. [(по состоянию на 5 июля 2022 г.)]. Доступно в Интернете: https://www.bms.com/assets/bms/ca/documents/productmonograph/SPRYCEL_EN_PM.pdf
EMA Sprycel — дазатиниб — научное обсуждение. 2006. [(по состоянию на 5 июля 2022 г.)]. Доступно в Интернете: https://www.bms.com/assets/bms/ca/documents/productmonograph/SPRYCEL_EN_PM.pdf
6. Дхарани С., Рахман З., Али С.Ф.Б., Афруз Х., Хан М.А. Количественная оценка диспропорционирования фенитоина натрия в препаратах с использованием вибрационной спектроскопии и многомерных методологий. Междунар. Дж. Фарм. 2018;25:65–74. doi: 10.1016/j.ijpharm.2018.01.005. [PubMed] [CrossRef] [Google Scholar]
7. Cutrignelli A., Sanarica F., Lopalco A., Lopedota A., Laquintana V., Franco M., Boccanegra B., Mantuano P., De Luca A. , Denora N. Водный состав на основе комплекса включения дазатиниб/HP-β-CD как многообещающее средство для лечения нервно-мышечных расстройств у детей. Междунар. Дж. Мол. науч. 2019;20:591. doi: 10.3390/ijms20030591. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
8. Агарвал В., Алаюби А., Сиддики А., Наззал С. Порошкообразные самоэмульгированные липидные составы мелоксикама в виде твердых лекарственных форм для перорального введения. Наркотик Дев. Инд. Фарм. 2013; 39: 1681–1689. doi: 10.3109/03639045.2012.729594. [PubMed] [CrossRef] [Google Scholar]
Наркотик Дев. Инд. Фарм. 2013; 39: 1681–1689. doi: 10.3109/03639045.2012.729594. [PubMed] [CrossRef] [Google Scholar]
9. Камбл Р.Н., Мехта П.П., Кумар А. Самоэмульгирующаяся система доставки лекарств эфавиренз: оценка in vitro и in vivo. AAPS PharmSciTech. 2016;17:1240–1247. дои: 10.1208/s12249-015-0446-2. [PubMed] [CrossRef] [Google Scholar]
10. Верма В., Шарма П., Шарма Дж., Ламба А.К., Ламба Х.С. Разработка, характеристика и исследование растворимости твердой дисперсии кверцетина методом выпаривания растворителя. Матер. Сегодня проц. 2017;4:10128–10133. doi: 10.1016/j.matpr.2017.06.334. [CrossRef] [Google Scholar]
11. Чхве Дж.С., Квон С.Х., Ли С.Е., Чан В.С., Бён Дж.С., Чон Х.М., Пак Дж.С. Использование подкислителя и солюбилизатора в твердой дисперсии тадалафила для улучшения растворения in vitro и пероральной биодоступности у крыс. Междунар. Дж. Фарм. 2017; 526:77–87. doi: 10.1016/j.ijpharm.2017.04.056. [PubMed] [CrossRef] [Академия Google]
12. Сон Дж. С., Юн Д.С., Сон Дж.Ю., Пак Дж.С., Чой Дж.С. Разработка и оценка нанокристаллов паклитаксела с модифицированной поверхностью лигандов-мишеней. Матер. науч. англ. С. 2017; 72: 228–237. doi: 10.1016/j.msec.2016.11.065. [PubMed] [CrossRef] [Google Scholar]
С., Юн Д.С., Сон Дж.Ю., Пак Дж.С., Чой Дж.С. Разработка и оценка нанокристаллов паклитаксела с модифицированной поверхностью лигандов-мишеней. Матер. науч. англ. С. 2017; 72: 228–237. doi: 10.1016/j.msec.2016.11.065. [PubMed] [CrossRef] [Google Scholar]
13. Choi Y.H., Han H.K. Наномедицины: Текущее состояние и перспективы на будущее в аспекте доставки лекарств и фармакокинетики. Дж. Фарм. расследование 2018;48:43–60. doi: 10.1007/s40005-017-0370-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Ременар Дж.Ф., Петерсон М.Л., Стивенс П.В., Чжан З., Зименков А.Ю., Хики М.Б. Целекоксиб: диссоциация никотинамида: использование вспомогательных веществ для захвата потенциала сокристалла. Мол. фарм. 2007; 4: 386–400. doi: 10.1021/mp0700108. [PubMed] [CrossRef] [Google Scholar]
15. Цунашима Д., Ямасита К., Огавара К.И., Сако К., Хигаки К. Получение твердых дисперсионных составов такролимуса с пролонгированным высвобождением с использованием этилцеллюлозы и гидроксипропилметилцеллюлозы методом выпаривания растворителя. Дж. Фарм. Фармакол. 2016;68:316–323. doi: 10.1111/jphp.12515. [PubMed] [CrossRef] [Академия Google]
Дж. Фарм. Фармакол. 2016;68:316–323. doi: 10.1111/jphp.12515. [PubMed] [CrossRef] [Академия Google]
16. Shah N., Iyer R.M., Mair H.J., Choi D., Tian H., Diodone R., Fahnrich K., Pabst-Ravot A., Tang K., Scheubel E. Повышение биодоступности вемурафениба у человека, практически нерастворимое лекарство с использованием твердой дисперсии, стабилизированной аморфным полимером, приготовленной в процессе соосаждения, контролируемого растворителем. Дж. Фарм. науч. 2013; 102:967–981. doi: 10.1002/jps.23425. [PubMed] [CrossRef] [Google Scholar]
17. Джермейн С.В., Бро С., Уильямс Р.О., III Аморфные твердые дисперсии и технологии нанокристаллов для доставки плохо растворимых в воде лекарств — обновление. Междунар. Дж. Фарм. 2018;535:379–392. doi: 10.1016/j.ijpharm.2017.10.051. [PubMed][CrossRef][Google Scholar]
18. Урбанец Н.А. Стабилизация твердых дисперсий нимодипина и полиэтиленгликоля 2000. Eur. Дж. Фарм. науч. 2006; 28: 67–76. doi: 10.1016/j.ejps.2005.12.009. [PubMed] [CrossRef] [Google Scholar]
19. Чаван Р.Б., Рати С., Джоти В.Г.С.С., Шастри Н.Р. Полимеры на основе целлюлозы в разработке аморфных твердых дисперсий. Азиатский Дж. Фарм. науч. 2019;14:248–264. doi: 10.1016/j.ajps.2018.09.003. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Чаван Р.Б., Рати С., Джоти В.Г.С.С., Шастри Н.Р. Полимеры на основе целлюлозы в разработке аморфных твердых дисперсий. Азиатский Дж. Фарм. науч. 2019;14:248–264. doi: 10.1016/j.ajps.2018.09.003. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
20. Влодарски К., Савицкий В., Палух К.Я., Тайбер Л., Грембека М., Хавелек Л., Войнаровска З., Гжибовска К., Талик Э., Палух М. Влияние методов аморфизации на кажущуюся растворимость и скорость растворения тадалафила. Евро. Дж. Фарм. науч. 2014;62:132–140. doi: 10.1016/j.ejps.2014.05.026. [PubMed] [CrossRef] [Google Scholar]
21. Tran P., Pyo Y.C., Kim D.H., Lee S.E., Kim J.K., Park J.S. Обзор методов производства твердых дисперсионных технологий для улучшения растворимости плохо растворимых в воде лекарств и применения к противоопухолевым препаратам. Фармацевтика. 2019;11:132. doi: 10.3390/фармацевтика11030132. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Roy S., Quiñones R., Matzger A.J. Структурные и физико-химические аспекты гидратной и безводной фаз дазатиниба. Кристалл. Рост Des. 2012;12:2122–2126. doi: 10.1021/cg300152p. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Кристалл. Рост Des. 2012;12:2122–2126. doi: 10.1021/cg300152p. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
23. Филипчик О.С., Мартаус А., Егоров А., Гавенда А., Аронхиме Дж., Враспир Р., Колтай Т., Фаустманн Дж., Габриэль Р. Полиморфы дазатиниба и способ их получения. № US20100256158A1. [(по состоянию на 5 июля 2022 г.)]; Патент. 2011 5 июля; Доступно в Интернете: https://patents.google.com/patent/US20100256158A1/en
24. Jimenez S.G., Fernandez L.A., Calzada J.V. Фармацевтическая композиция, содержащая аморфный дазатиниб. № WO2017108605. [(по состоянию на 5 июля 2022 г.)]; PCT. 2017 29 июня; Доступно в Интернете: https://patentscope.wipo.int/search/en/detail.jsf?docId=WO2017108605
25. Двиведи С.Д., Сингх К.К., Сингх Н.К., Патил А.К. Способ получения аморфной формы дазатиниба. № US9249134B2. [(по состоянию на 5 июля 2022 г.)]; Патент. 2016 2 февраля; Доступно в Интернете: https://patents.google.com/patent/US9249134B2/en
26. Мохамед Э.М., Хуроо Т. , Афруз Х., Дхарани С., Седири К., Кук П., Арунагири Р., Хан М.А., Рахман З. Разработка многомерной прогнозирующей модели растворения для таблеток с покрытием со смесями эфиров целлюлозы. Фармацевтика. 2020;13:311. doi: 10.3390/ph23100311. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Афруз Х., Дхарани С., Седири К., Кук П., Арунагири Р., Хан М.А., Рахман З. Разработка многомерной прогнозирующей модели растворения для таблеток с покрытием со смесями эфиров целлюлозы. Фармацевтика. 2020;13:311. doi: 10.3390/ph23100311. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Рауф Р., Вахаб З.А., Ибрагим Н.А., Талиб З.А., Чиенг Б.В. Прозрачная смесь бутирата поли(метилметакрилата)/ацетата целлюлозы для защиты от ультрафиолета. Полимеры. 2016;8:128. дои: 10.3390/полим8040128. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Chiou W.L., Riegelman S. Pharmaceutical Applications of Solid Dispersion Systems. Дж. Фарм. науч. 1971; 60: 1281–1302. doi: 10.1002/jps.2600600902. [PubMed] [CrossRef] [Google Scholar]
29. Мартинес-Охаррис М.С., Мартин С., Гоньи М.М., Родригес-Эспиноса С., Трос-Илардуя М.С., Зорноза А. Влияние полиэтиленгликоля 4000 на полиморфные формы Дифлюнизал. Евро. Дж. Фарм. науч. 1999; 8: 127–132. дои: 10.1016/S0928-0987(99)00006-8. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
30. Могал С.А., Гурджар П.Н., Ямгар Д.С., Камод А.С. Метод твердой дисперсии для улучшения растворимости некоторых плохо растворимых лекарств. Дер Фарм. лат. 2012; 4: 1574–1586. [Google Scholar]
31. Шете С., Гадхаве В., Гайквад Д. Повышение растворимости и скорости растворения симвастатина методом трехкомпонентной твердой дисперсии. Дж. Фарм. науч. Инновации. 2015;3:36–41. [Google Scholar]
32. ICH . Руководство для промышленности — валидация аналитических процедур Q2B: методология. Патентное ведомство США; Александрия, Вирджиния, США: 2005. с. 1996. [Google Scholar]
33. Общие главы: <1225> Валидация компендиальных процедур. Фармакопея; Роквилл, Мэриленд, США: 2018. стр. 7665–7671. [Google Scholar]
34. Нирали Г.П., Абу Т.М.С. Сорбция влаги полимерными наполнителями, обычно используемыми в аморфных твердых дисперсиях, и ее влияние на температуру стеклования: I. Поливинилпирролидон и родственные сополимеры. Междунар. Дж. Фарм. 2022;616:121532. [PubMed] [Google Scholar]
Дж. Фарм. 2022;616:121532. [PubMed] [Google Scholar]
35. Haldon R.A., Schell W.J., Simha R. Переходы в стеклах при низких температурах. Дж. Макромоль. науч. Часть Б. 1967;1:759–775. doi: 10.1080/00222346708212360. [CrossRef] [Google Scholar]
36. Браун Э., Ворку З.А., Хили А.М. Физико-химические свойства поливиниловых полимеров и их влияние на характеристики аморфной твердой дисперсии кетопрофена: пример выбора полимера. Фармацевтика. 2020;12:433. doi: 10.3390/фармацевтика12050433. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
37. Wu J.X., Yang M., Van Den Berg F., Pajander J., Rades T., Rantanen J. Влияние скорости испарения растворителя и состава Факторы физической стабильности твердых дисперсий. Евро. Дж. Фарм. науч. 2011;44:610–620. doi: 10.1016/j.ejps.2011.10.008. [PubMed] [CrossRef] [Академия Google]
38. Тран Т.Т.Д., Тран П.Х.Л. Молекулярные взаимодействия в твердых дисперсиях малорастворимых в воде лекарственных средств. Фармацевтика. 2020;12:745. doi: 10.3390/фармацевтика12080745. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2020;12:745. doi: 10.3390/фармацевтика12080745. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Guo L., Sato H., Hashimoto T., Ozaki Y. FTIR-исследование взаимодействий водородных связей в биоразлагаемых полимерных смесях поли(3- гидроксибутират) и макромолекулы поли(4-винилфенола). 2010;43:3897–3902. дои: 10.1021/ma100307m. [Перекрестная ссылка] [Академия Google]
40. Куцык А.М., Ильченко О.О., Юзвенко Ю.М., Обуховский В.В., Никонова В.В. Колебательная спектроскопия комплексообразования в водных растворах изопропанола. Укр. Дж. Физ. 2018; 63: 506–512. doi: 10.15407/ujpe63.6.506. [CrossRef] [Google Scholar]
41. Кумар П., Мохан С., Канамсринивасан М., Гулати М. Изучение физико-химических характеристик и скорости высвобождения твердых дисперсий кетоконазола с плюроником F127 и ПВП К-30. Иран. Дж. Фарм. Рез. 2011;10:685–694. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Мартинес Л.М., Видеа М., Соса Н.Г., Рамирес Дж.Х., Кастро С. Долговременная стабильность новых коаморфных бинарных систем лекарственных средств: изучение стеклования в зависимости от состава и времени хранения. Молекулы. 2016;21:1712. doi: 10,3390/молекулы21121712. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Долговременная стабильность новых коаморфных бинарных систем лекарственных средств: изучение стеклования в зависимости от состава и времени хранения. Молекулы. 2016;21:1712. doi: 10,3390/молекулы21121712. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Суреш К., Эш Дж.С., Мацгер А.Дж. Спектроскопия в дальней инфракрасной области как зонд для различения полиморфов. Дж. Фарм. науч. 2019;108:1915–1920. doi: 10.1016/j.xphs.2018.12.020. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Вестад Ф., Шмидт А., Кермит М. Включение присвоения химических полос в регрессионные модели спектроскопии ближнего инфракрасного диапазона. J. Ближний инфракрасный спектр. 2008; 16: 265–273. doi: 10.1255/jnirs.786. [CrossRef] [Google Scholar]
45. Nishimoto Y., Hattori Y., Otsuka M. Характеристика тройной аморфной твердой дисперсии, содержащей фталат гипромеллозы и эритрит, полученной экструзией горячего расплава с понижением температуры плавления. Дж. Друг Делив. науч. Технол. 2020;58:101797. doi: 10.1016/j.jddst.2020.101797. [CrossRef] [Google Scholar]
Друг Делив. науч. Технол. 2020;58:101797. doi: 10.1016/j.jddst.2020.101797. [CrossRef] [Google Scholar]
46. Исида Ю., Мураи К., Ямагучи К., Миягишима Т., Синдо М., Огава К., Нагашима Т., Сато С., Ватанабэ Р., Исследовательская группа Inter-Michinoku Dasatinib (IMIDAS) и соавт. Фармакокинетика и фармакодинамика дазатиниба в хронической фазе недавно диагностированного хронического миелоидного лейкоза. Евро. Дж. Клин. Фармакол. 2016;72:185–193. doi: 10.1007/s00228-015-1968-y. [PubMed] [CrossRef] [Google Scholar]
47. Christopher L.J., Cui D., Wu C., Luo R., Manning J.A., Bonacorsi S.J., Lago M., Allentoff A., Lee F.Y.F., McCann B., и другие. Метаболизм и утилизация дазатиниба после перорального введения человеку. Препарат Метаб. Утилизация 2008; 36: 1357–1364. doi: 10.1124/dmd.107.018267. [PubMed] [CrossRef] [Академия Google]
48. Миура М. Терапевтический лекарственный мониторинг иматиниба, нилотиниба и дазатиниба у пациентов с хроническим миелоидным лейкозом. биол. фарм. Бык. 2015; 38: 645–654. doi: 10.1248/bpb.b15-00103. [PubMed] [CrossRef] [Google Scholar]
фарм. Бык. 2015; 38: 645–654. doi: 10.1248/bpb.b15-00103. [PubMed] [CrossRef] [Google Scholar]
Как использовать ASD для доставки нерастворимых лекарств
Аморфные твердые дисперсии (ASD) получили экспоненциальное распространение с конца 1990-х годов. Рост частично связан с высоким процентом плохо растворимых в воде соединений в лекарственных препаратах. Доступность новых крупномасштабных производственных технологий также является важным фактором.
Несколько новых продуктов ASD, изготовленных с использованием различных технологий, получили одобрение на продажу в этом столетии. ASD до сих пор не полностью используются для доставки лекарств-кандидатов на клинических и коммерческих стадиях из-за отсутствия полного понимания свойств твердой дисперсии и надежного прогнозирования масштабирования продукта, стабильности и эффективности in-vivo.
Контрактные организации по разработке и производству (CDMO), которые понимают ASD и их связь с последующим масштабированием продукта, стабильностью и производительность in-vivo может оказаться бесценным партнером. Они могут успешно использовать ASD для доставки нерастворимых лекарств на ранней стадии разработки и коммерциализации лекарств для людей своевременным и экономически эффективным способом.
Они могут успешно использовать ASD для доставки нерастворимых лекарств на ранней стадии разработки и коммерциализации лекарств для людей своевременным и экономически эффективным способом.
Всасывание перорально вводимых твердых лекарственных форм в системный кровоток зависит от трех факторов. Распад лекарственной формы, растворение лекарственного средства и проникновение лекарственного средства через клеточные мембраны кишечника в системный кровоток — все это влияет на всасывание лекарственного средства.
Всасывание многих плохо растворимых в воде лекарственных средств, особенно соединений BCS II, часто ограничивается скоростью растворения лекарственного средства из лекарственных форм (kd<
Эффективную площадь поверхности растворения можно увеличить, уменьшив размер частиц до микронного или нанометрового уровня. Это может быть достигнуто за счет повышения смачиваемости гидрофобного лекарственного средства, тогда как улучшение растворимости может быть достигнуто за счет выбора формы полиморфа/соли, комплексообразования, солюбилизации, пролекарства, микроэмульсии, аморфного образования и твердой дисперсии. Поскольку потенциально повышенная кажущаяся растворимость может превышать 1000 раз в результате аморфного образования, АСД могут улучшать биодоступность соединений БКС II и IV до приемлемого уровня без изменения молекулярной структуры в соответствии с ними. Это основано на модели максимальной поглощенной дозы (MAD):
Нестабильность аморфных материалов Одним из основных препятствий при коммерциализации ASD является физико-химическая стабильность. Из-за присущего аморфным материалам высокого состояния свободной энергии по сравнению с кристаллическими они имеют высокую степень пересыщения. Следовательно, они обладают высокой кажущейся растворимостью, что приводит к высокой скорости растворения.
Из-за присущего аморфным материалам высокого состояния свободной энергии по сравнению с кристаллическими они имеют высокую степень пересыщения. Следовательно, они обладают высокой кажущейся растворимостью, что приводит к высокой скорости растворения.
По той же причине высока термодинамическая движущая сила рекристаллизации в физическую форму с более низкой энергией, что ставит под угрозу стабильность и скорость растворения. ASD обладают высокой энтропией, энтальпией и термодинамической свободной энергией по сравнению с их кристаллической формой. Поскольку стабильность лекарственной формы будет определяться аморфным лекарственным средством API, хорошая физико-химическая характеристика и точное предсказание стабильности аморфного лекарственного средства необходимы для успеха ASD.
Большинство низкомолекулярных фармацевтических препаратов с Tg <75°C легко перекристаллизовываются во время стабилизации или растворения in vivo. Часто необходимо добавлять эксципиенты, особенно полимеры, для образования многокомпонентной аморфной системы (т. е. АСД) для стабилизации и предотвращения кристаллизации аморфного лекарственного средства в его твердом или водном состояниях. Добавление стабилизаторов в многокомпонентную аморфную систему оптимизирует стабильность аморфных лекарственных средств, а также улучшит функциональность аморфной лекарственной формы и удобство обращения с ней.
е. АСД) для стабилизации и предотвращения кристаллизации аморфного лекарственного средства в его твердом или водном состояниях. Добавление стабилизаторов в многокомпонентную аморфную систему оптимизирует стабильность аморфных лекарственных средств, а также улучшит функциональность аморфной лекарственной формы и удобство обращения с ней.
Чтобы использовать более высокую растворимость аморфных твердых веществ и снизить риски физической нестабильности, группы разработчиков лекарств должны понимать молекулярную структуру твердых дисперсий. Их взаимосвязь с физико-химическими свойствами способствует развитию стабильных РАС. Смешиваемость лекарственного средства с полимером и растворимость кристаллического лекарственного средства в твердом состоянии в полимерных матрицах важны для физической стабильности АСД. Понимание этих двух свойств поможет выбрать подходящий полимер и определить оптимальный уровень загрузки аморфного лекарственного средства для рационального создания стабильного состава ASD.
На рис. 1 показана типичная фазовая диаграмма двухкомпонентной системы растворов с зазором смешиваемости (рис. 1). Фазовая диаграмма разделена на области, показывающие однофазные стабильные и двухфазные метастабильные и нестабильные фазы. Бинодаль отделяет стабильную гомогенную фазу от двухфазных областей, тогда как спинодаль разделяет двухфазную область на метастабильную и неустойчивую фазы. Фазовое расслоение может быть вызвано скачком температуры или флуктуациями концентрации, вызывающими переход системы из однофазной стабильной фазы в неустойчивые области.
Фазовое разделение может следовать двум различным механизмам, называемым зародышеобразованием и ростом, и спинодальным распадом, в зависимости от расположения области. Зарождение и рост — это когда разделение фаз происходит внутри двухфазной метастабильной области вблизи бинодальной линии, где изменение свободной энергии для разделения фаз низкое. Поскольку зародышеобразование включает создание новой поверхности, для зарождения и роста требуется энергетический барьер активации.
Для дисперсии с составом, находящимся в пределах спинодальной области, система, неустойчивая к любым колебаниям концентрации, будет подвергаться фазовому расслоению посредством спинодального распада. Несмотря на отсутствие термодинамического энергетического барьера для спинодального распада, фазовое разделение может быть остановлено или стать чрезвычайно медленным, когда температура ниже температуры стеклования системы.
Гомогенная молекулярная смесь лекарственного средства и полимера При обработке АСД в виде системы растворов лекарство и полимер, образующие АСД, должны быть смешиваемыми для образования стабильной, гомогенной молекулярной смеси лекарственного средства и полимера. Как минимум, лекарство и полимер должны смешиваться в жидком/расплавленном состоянии. В противном случае в твердой дисперсии, образующейся при затвердевании, будут присутствовать метастабильные аморфные фазы, богатые лекарственным средством, а также фазы, богатые полимером. Последующие возмущения, такие как колебания температуры или концентрации, вызовут перекристаллизацию метастабильного аморфного лекарства в системе. В общем, считается, что образование одной фазы в виде аморфного твердого раствора необходимо для стабильности аморфного лекарственного средства в системе твердой дисперсии.
Последующие возмущения, такие как колебания температуры или концентрации, вызовут перекристаллизацию метастабильного аморфного лекарства в системе. В общем, считается, что образование одной фазы в виде аморфного твердого раствора необходимо для стабильности аморфного лекарственного средства в системе твердой дисперсии.
Рекристаллизация аморфного лекарственного средства в твердой дисперсии может быть значительно замедлена или уменьшена за счет:
♦ Повышения температуры стеклования
♦ Уменьшения молекулярной подвижности лекарственного средства
♦ Взаимодействия лекарство-полимер
♦ Повышения в критическом энергетическом барьере кристаллизации за счет снижения термодинамической движущей силы
♦ Вмешательство в процесс молекулярного распознавания для рекристаллизации.
Все механизмы стабилизации требуют смешения лекарственного средства и полимера и взаимодействия на молекулярном уровне. Когда в аморфной системе лекарственное средство-полимер происходит разделение фаз, полимер оказывает ограниченное влияние на стабильность аморфного лекарственного средства, присутствующего в богатой лекарственным средством фазе.
На основе термодинамических теорий разделения фаз следует подготовить АСД. Это следует делать при концентрации препарата ниже растворимости в твердом состоянии его кристаллической формы, чтобы дисперсионная система попадала в однофазную стабильную область, а лекарство однородно распределялось в твердой матрице на молекулярном уровне. В противном случае, когда загрузка аморфного лекарственного средства по практическим соображениям превышает его растворимость в твердом состоянии, система может стать пересыщенной и попасть в метастабильные двухфазные области. В этом сценарии часть лекарственного средства может присутствовать в метастабильной аморфной форме.
Разработка и масштабирование рецептурПроцесс разработки рецептур ASD состоит из следующих этапов:
- Проверка рецептуры
- Выбор полимера на основе результатов первого этапа
- Тестирование стабильности и прогнозирование долговременной стабильности
- Оценка биофармацевтических препаратов in-vitro и in-vivo
- Выбор метода изготовления для ASD
- Разработка и масштабирование процесса для конечной лекарственной формы
- Характеристика лекарственных форм
- IVVC
В зависимости от стадии разработки могут быть выбраны различные лекарственные формы АСД. На ранних стадиях предпочтительны подходы с водной суспензией или препаратом в бутылке, которые могут быть легко приготовлены в токсикологической лаборатории или в отделении клинической фармакологии из порошка ASD. Начиная с Фазы 2, желателен рыночный состав в виде капсул или таблеток, чтобы избежать дорогостоящего промежуточного исследования фармакокинетики перед переходом к базовому исследованию на людях Фазы 3 (таблица 1).
На ранних стадиях предпочтительны подходы с водной суспензией или препаратом в бутылке, которые могут быть легко приготовлены в токсикологической лаборатории или в отделении клинической фармакологии из порошка ASD. Начиная с Фазы 2, желателен рыночный состав в виде капсул или таблеток, чтобы избежать дорогостоящего промежуточного исследования фармакокинетики перед переходом к базовому исследованию на людях Фазы 3 (таблица 1).
Для команды CDMO очень важно выбрать надежную стабильную формулу и учесть эффекты масштабирования на ранней стадии разработки. Распылительная сушка хорошо зарекомендовала себя и широко используется для преобразования жидких составов в сухие порошкообразные формы. Производственный процесс распылительной сушки состоит из пяти этапов, как показано на рис. 2.
Температура и скорость испарения на входе и выходе из распылительной сушилки могут контролировать микрометрические свойства высушенного распылением порошка твердой дисперсии.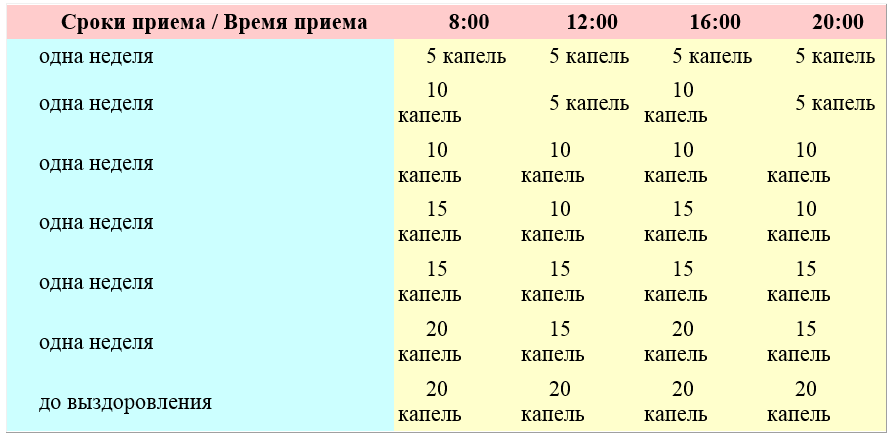 Разделение фаз лекарственного средства и полимера можно предотвратить за счет быстрого удаления растворителя из капель распыляемого раствора и последующего быстрого затвердевания капель.
Разделение фаз лекарственного средства и полимера можно предотвратить за счет быстрого удаления растворителя из капель распыляемого раствора и последующего быстрого затвердевания капель.
Технологии экструзии горячего расплава и заполнения жидким расплавом для инкапсуляции твердых дисперсий расплава в твердые капсулы являются альтернативой твердым дисперсиям. Изготовление лекарственной формы СД включает растворение лекарственных средств в расплавленных носителях и заливку растворов в твердые желатиновые капсулы. Благодаря простоте производственных процессов и потенциалу значительного улучшения биодоступности плохо растворимых в воде лекарственных средств, твердые дисперсионные системы по технологии с жидким наполнением являются привлекательным вариантом для разработки нерастворимых лекарственных средств.
Три параметра процесса масштабирования CDMO должны сосредоточиться на трех критических параметрах процесса при масштабировании: распыление, сушка и разделение.
 Именно амиды виноваты в резком неприятном запахе препарата;
Именно амиды виноваты в резком неприятном запахе препарата;